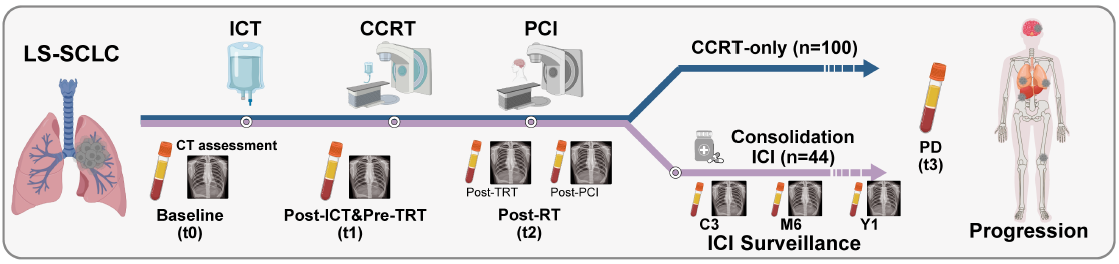
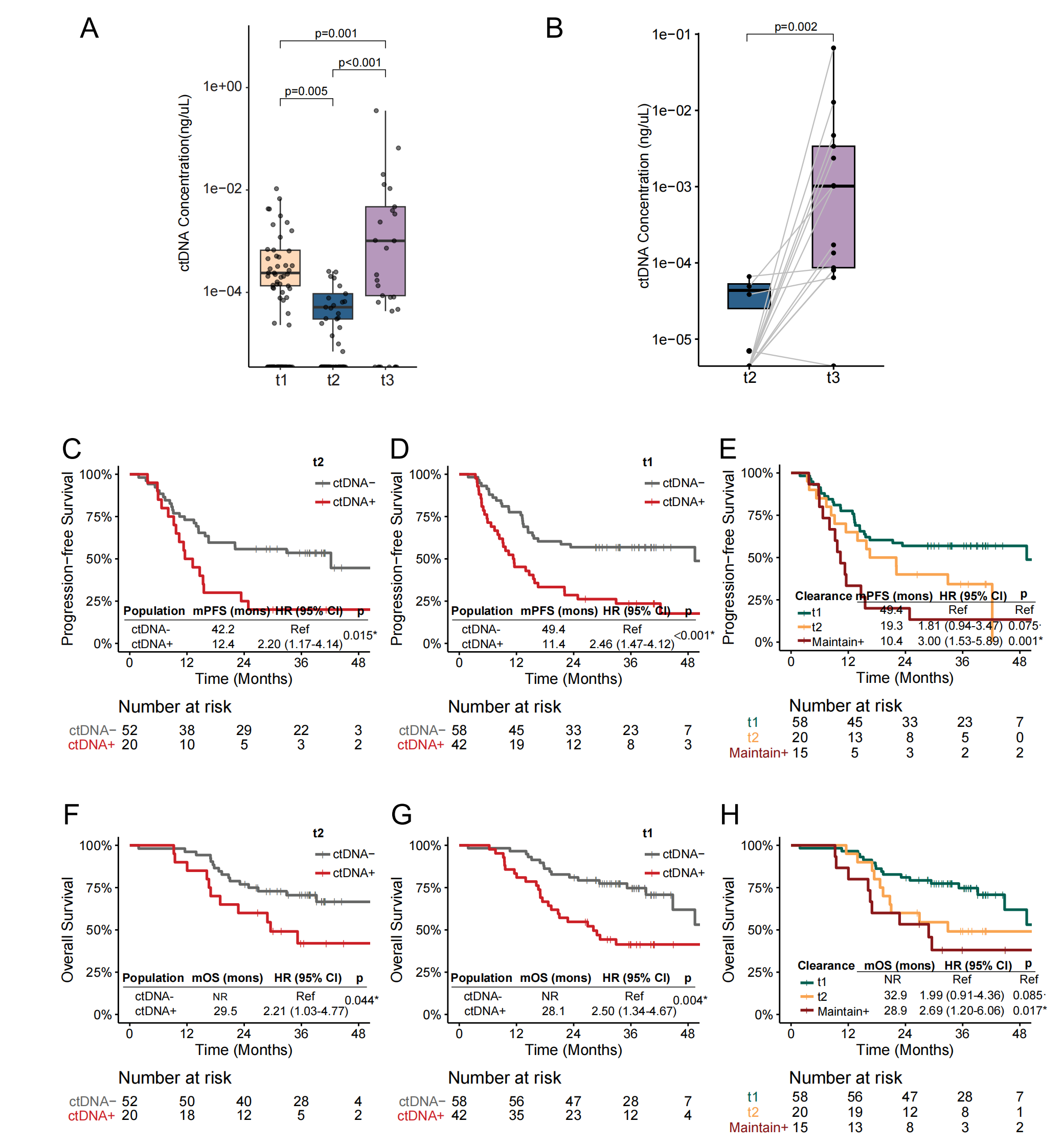
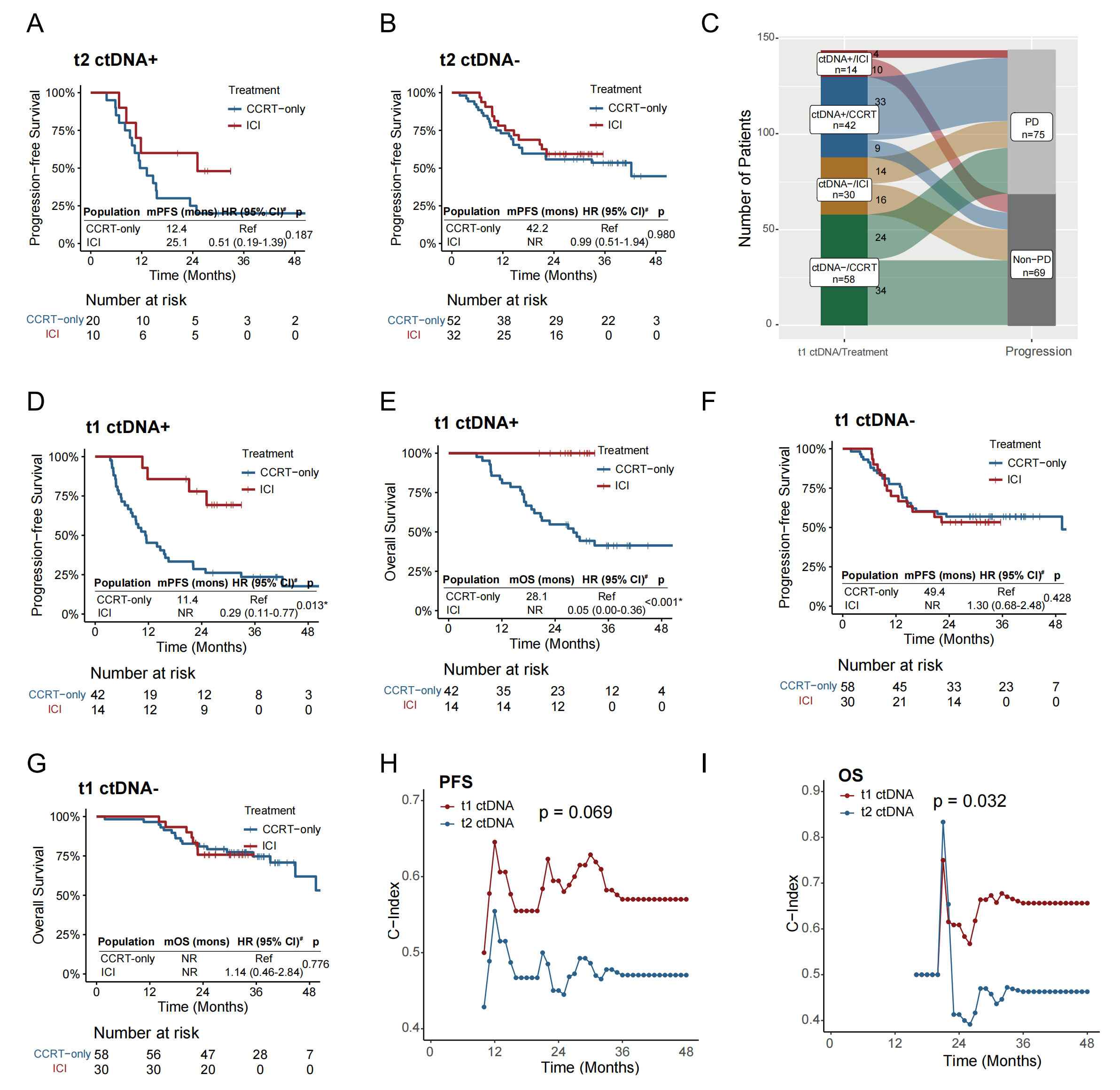
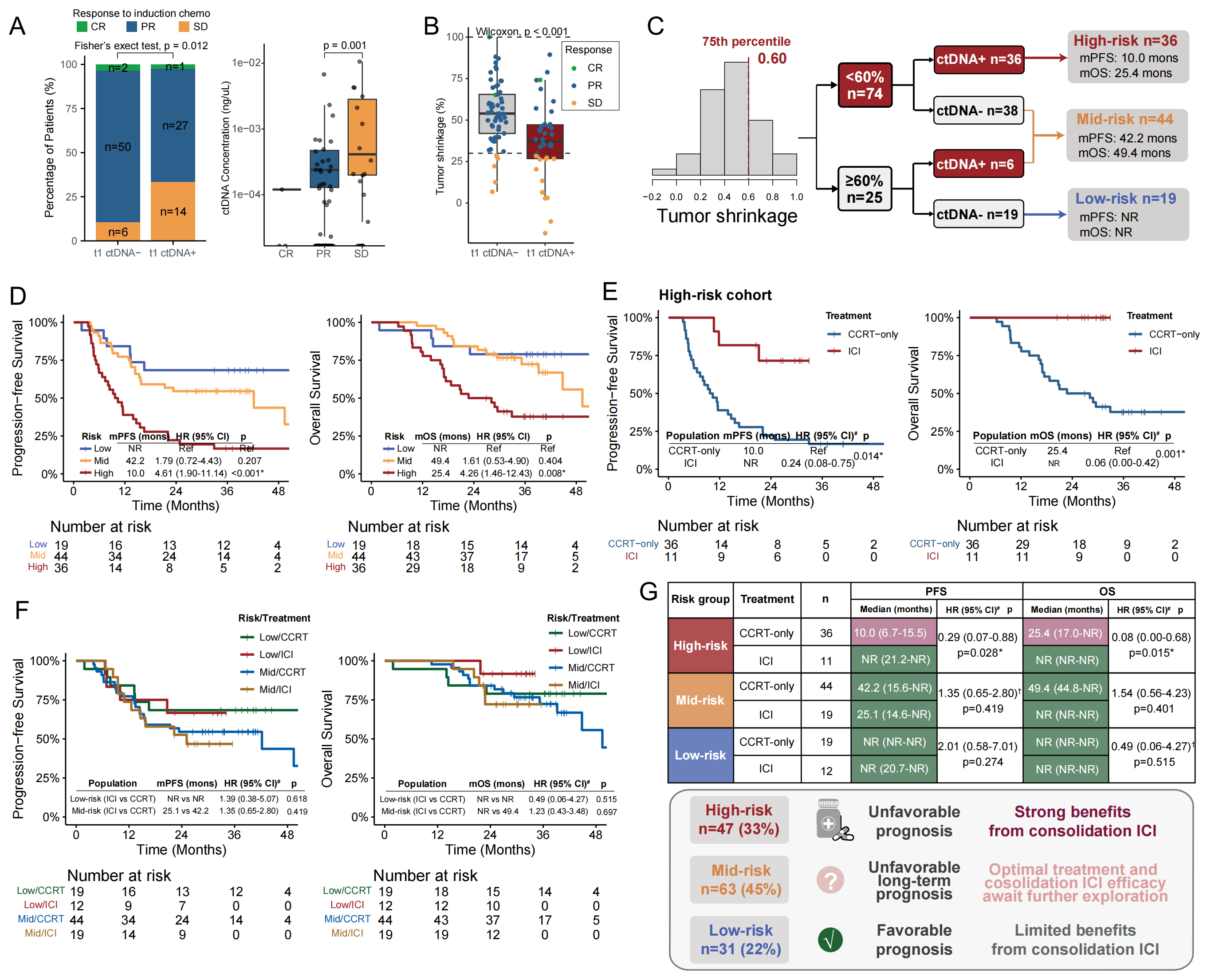
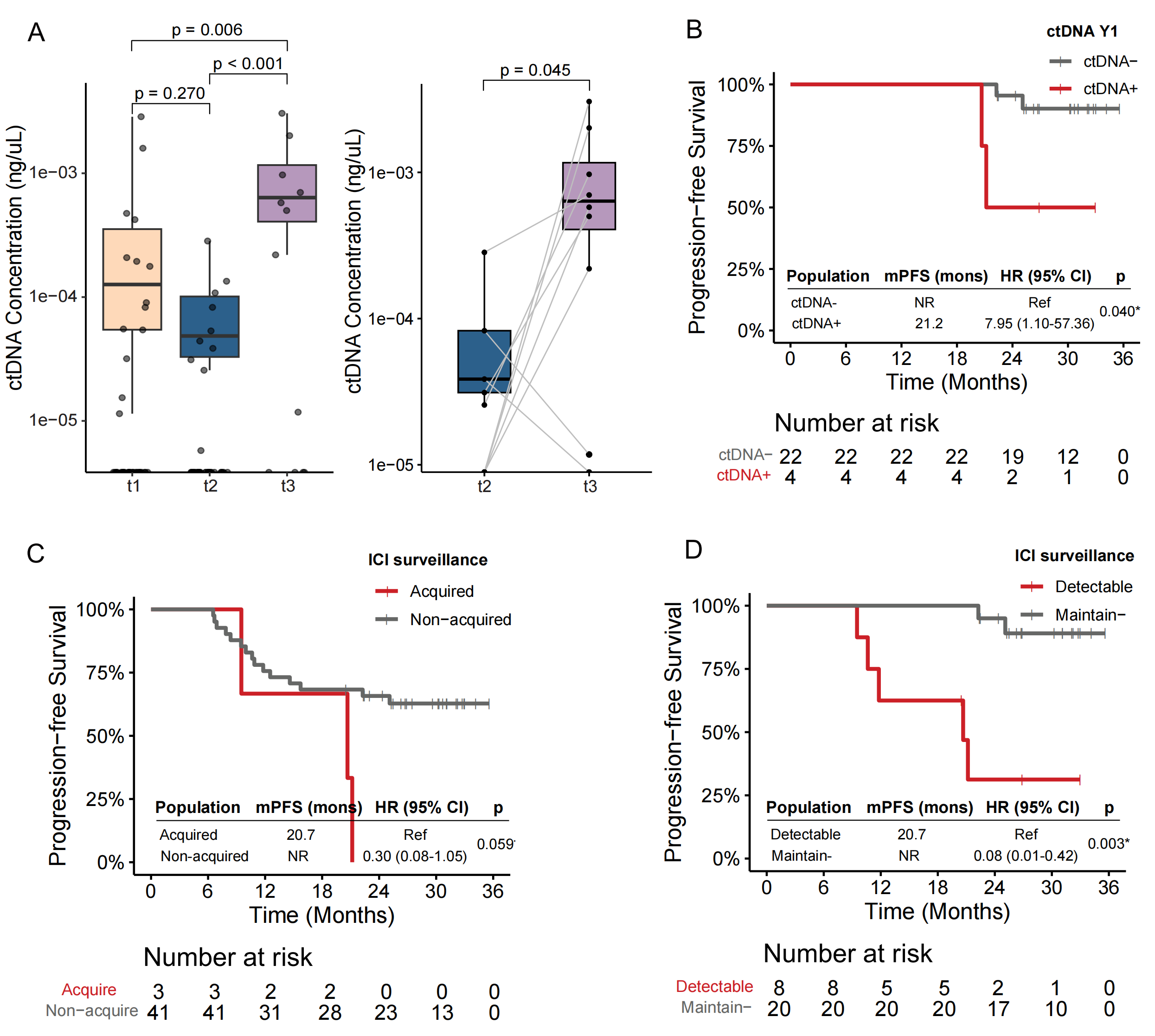
导语 近日,中国医学科学院肿瘤医院王绿化教授、毕楠教授、王志杰教授团队与世和基因合作的CALIBRATE-SCLC-CCRT研究登顶国际权威期刊Signal Transduction and Targeted Therapy(IF = 52.7)。研究采用世和术宁®MRD检测产品,探索了ctDNA在局限期小细胞肺癌(LS-SCLC)同步放化疗(CCRT)后巩固免疫(ICI)治疗中的指导价值。 研究亮点 1. 首次明确ctDNA在局限期小细胞肺癌同步放化疗后巩固免疫治疗中的预测价值。 2. 打破仅关注放疗后ctDNA状态的传统,发现诱导化疗后胸部放疗前的ctDNA状态对巩固免疫治疗的预测效能更佳。 3. 创新融合ctDNA状态与影像学构建的三级风险分层模型,在识别巩固免疫治疗获益人群方面比单一指标更精准。 研究背景 小细胞肺癌是一种侵袭性极强的恶性肿瘤,其中1/3是LS-SCLC,既往标准治疗方案是CCRT联合/不联合预防性脑放疗(PCI)。然而,许多患者在治疗后出现进展,整体中位生存时间仅25 - 30个月。ADRIATIC研究显示,CCRT后巩固免疫(ICI)治疗患者生存得到显著提升,该方案因此成为LS-SCLC的新标准治疗。但值得注意的是,大约25%的患者仅通过CCRT就能治愈,提示部分患者存在过度治疗的情况。而传统的免疫疗效预测标志物,如PD-L1表达、TMB和分子分型等,在LS-SCLC中预测效果并不理想。因此,临床迫切需要探索能够在治疗早期对患者进行分层的标志物,以便更加精准指导临床决策。 研究内容 研究共纳入144例LS-SCLC患者,其中100例仅接受CCRT治疗,44例接受CCRT+巩固ICI治疗(图1)。分别在治疗前基线(t0)、诱导化疗(ICT)后胸部放疗(TRT)前(t1)、放疗结束后(t2)、疾病进展时(t3)、巩固ICI治疗组的第3周期(C3)、第6个月(M6)以及第12个月(Y1)时进行血浆采样(图1)。 截至2025年4月20日,52.1%的患者出现疾病进展,33.3%的患者死亡。CCRT组的中位随访时间为37.8个月(IQR:33.3–44.5),ICI组为30.1个月(IQR:25.5–32.1)。 图1. 研究设计 研究结果 1、诱导化疗后和放疗结束后两个时间点的ctDNA阳性提示不良预后 在仅接受CCRT的患者中,ctDNA浓度从t1到t2显著下降(p = 0.005),但在t3点上升(p < 0.001)(图2A)。在t2和t3同时送检的配对样本中,这一趋势跟总人群一致(图2B)。生存分析显示,t2点ctDNA阳性提示更短的无进展生存期(PFS)(HR = 2.20,p = 0.015)和总生存期(OS)(HR = 2.21,p = 0.044)(图2C, F)。 将t1点ctDNA阴性的患者定义为早期ctDNA清除。t1点ctDNA阳性与更差的PFS(HR = 2.46,p < 0.001)和OS(HR = 2.50,p = 0.004)相关(图2D, G)。与t2点ctDNA延迟清除的患者相比,t1点早期清除的患者PFS(HR = 1.81,p = 0.075)和OS(HR = 1.99,p = 0.085)有更长的趋势(图2E, H)。而从t1到t2持续ctDNA阳性的患者,PFS(HR = 3.00,p = 0.001)和OS(HR = 2.69,p = 0.017)显著更差(图2E, H)。 图2. CCRT治疗组中t1和t2点ctDNA对LS-SCLC患者PFS和OS的预测价值 2、诱导化疗后胸部放疗前的ctDNA状态,可精准识别巩固免疫治疗获益人群 t2点ctDNA阳性的患者,接受巩固ICI治疗后显示出PFS改善的趋势(HR = 0.51,p = 0.187)(图3A)。而t2点ctDNA阴性的患者,接受巩固ICI治疗并未改善其PFS(HR = 0.99,p = 0.980)(图3B)。 鉴于巩固ICI治疗可显著降低胸外转移风险,研究进一步评估了早期t1点ctDNA状态是否可以预测ICI巩固治疗获益。结果表明,t1点ctDNA阳性的患者,接受巩固ICI治疗有显著更低的进展率(p < 0.001)、更长的PFS(HR = 0.29,p = 0.013)和OS(HR = 0.05,p < 0.001)(图3C-E)。Cox多因素分析校正后发现,t1点ctDNA阳性的患者中,巩固ICI治疗与改善的PFS和OS独立相关。而在t1点ctDNA阴性组中两种治疗策略并未观察到PFS和OS的差异(图3F, G)。另外,在接受巩固ICI治疗的患者中,t1点ctDNA对于PFS和OS预测的C-index高于t2点(图3H, I),提示t1点ctDNA状态在巩固ICI治疗决策和疗效预测中更具价值。 图3. ctDNA检测与巩固ICI治疗下临床结果的关联性 3、整合ctDNA状态与影像学的预后分层模型,可进一步提升预测精准度 t1点ctDNA状态和浓度与疾病稳定(SD)显著相关(图4A),且ctDNA阳性的患者在t1点肿瘤缩小程度显著降低(p < 0.001)(图4B)。这一结果表明,t1点ctDNA状态不仅能够反映残留肿瘤负荷,也为将ctDNA与影像学应答相结合作为预后分层策略提供了有力依据。 为识别出仅CCRT治疗预后较好的患者,研究整合影像学和t1点ctDNA状态构建预后分层模型,以60%(第75百分位数)的肿瘤缩小作为阈值结合t1点ctDNA状态将患者划分为低、中和高风险三组(图4C)。中风险组的2年和4年PFS率低于低风险组(2年:54.5% vs. 68.4%;4年:43.6% vs. 68.4%)(图4D)。与低风险组相比,高风险组PFS(HR = 4.61,p < 0.001)和OS(HR = 4.26,p = 0.008)均显著更短(图4D)。 进一步探索各风险组的最佳治疗模式。在高风险组中,接受巩固ICI治疗的患者PFS(HR = 0.24,p = 0.014)和OS(HR = 0.06,p = 0.001)均显著延长(图4E)。而在中风险和低风险组中仅观察到巩固ICI治疗的短期获益(图4F)。多因素分析显示,高风险组可从巩固ICI治疗中显著获益,而低风险组和中风险组获益有限(图4G)。 图4. 整合t1点ctDNA结果和影像学肿瘤缩小情况可对患者进行预后分层 4、巩固免疫治疗期间的ctDNA动态监测,可提前预警复发并指导后续治疗决策 巩固ICI队列的患者,放疗后ctDNA浓度和平均突变丰度均有所下降,随后在进展时达到峰值,在有配对的t2和t3点样本中观察到一致的趋势(图5A)。值得关注的是,Y1点ctDNA阳性的患者,PFS更短(HR = 7.95,p = 0.040)(图5B)。监测期间,未出现ctDNA阳性的患者PFS更长(HR = 0.30,p = 0.059)(图5C)。同时,在监测过程中持续ctDNA阴性的患者与至少有一次ctDNA阳性的患者相比,PFS显著延长(HR = 0.08,p = 0.003)(图5D)。 图5. 巩固ICI治疗期间的ctDNA监测可预测临床结局 结语 本研究是国际上首个探索ctDNA在LS-SCLC患者同步放化疗后巩固免疫治疗决策与预后评估中应用价值的研究。研究证实,t1和t2点的ctDNA状态均可精准预测预后。特别值得提出的是,t1点ctDNA状态可精准筛选出巩固ICI治疗获益人群,有助于低风险患者避免不必要的免疫毒性、并减少相关经济负担。t1点ctDNA状态与影像学肿瘤缩小度相结合,可实现对患者的三级风险分层,筛选出能从巩固ICI治疗中获益的高风险患者。此外,巩固ICI治疗期间进行ctDNA动态监测,可提前预警复发并指导后续治疗。 该研究为LS-SCLC免疫治疗时代的治疗决策提供了创新性的生物标志物方案,并为前瞻性干预试验与真实世界的临床应用奠定了核心证据基础,推动LS-SCLC治疗向更精准、更个体化方向迈进。 专家简介 王绿化 教授 中国医学科学院肿瘤医院深圳医院院长 主任医师 博士生导师 国务院政府特殊津贴专家 深圳市国家级领军人才 中华医学会理事 中华医学会放射肿瘤学分会第九届委员会主委 国家癌症中心国家肿瘤质控中心食管癌质控专家委员会主委 中国临床肿瘤学会(CSCO)副监事长 国家肿瘤规范化诊治质控中心常务副主任 国家抗肿瘤药物临床应用监测专家委员会肺癌组副组长 国家肿瘤质控中心放射治疗质控专家委员会指导委员 中华医学会北京放射肿瘤学分会副主委 国家卫生健康委《食管癌诊疗指南(2022年版)》编写审定专家组组长 《中华放射肿瘤学杂志》副主编 毕楠 教授 中国医学科学院肿瘤医院放疗科副主任,胸组主任 主任医师 博士研究生导师 分子肿瘤全国重点实验室PI,美国密歇根大学放疗科访问学者 国家优秀青年医师 CSCO理事、 SCLC专委会副主委、NSCLC 专委会常委、放疗专委会委员 中华医学会放疗分会委员 抗癌协会肺癌专委会、肿瘤放疗专委会委员 国家卫健委原发性肺癌规范化诊疗指南审定专家、 CSCO 《非小细胞肺癌、小细胞肺癌指南》执笔专家 获IASLC ‘Developing Nation Award’、国家科技进步二等奖、三项省部级科技进步二等奖、北京优秀医师、国之名医等奖项 第一/通讯作者在Lancet Oncol、J Clin Oncol、Ann Oncol、Mol Cancer(2)、Clin Cancer Res(2)、 Cancer Res、 Int J Radiat Oncol Biol Phys(专业顶刊,3)、Radiother Oncol (专业顶刊,7)等发表论文,成果入选美国放疗学会ASTRO CME课程、C100、ESI高引论文。 王志杰 教授 中国医学科学院肿瘤医院 主任医师、肿瘤学博士、博士研究生导师 长期致力于肺癌、胸膜间皮瘤、胸腺肿瘤、纵膈肿瘤及肉瘤等的临床及转化研究,尤其擅长肺癌分子分型、外周血基因检测,以及肺癌的化疗、分子靶向治疗和免疫治疗为基础的综合治疗,注重肿瘤患者的全程化管理。 入选教育部“长江学者”特聘教授、国家“万人计划”青年拔尖人才、北京市科技新星和北京市优秀人才计划等。主持多项国家级及省部级课题,发表高影响力论文40余篇,获得国家科技进步奖二等奖及教育部“高等学校科技进步奖”一等奖。 兼任国家肺癌质控专委会、中国临床肿瘤学会(CSCO)、中国抗癌协会肺癌专委会、中华医学会肿瘤分会等学会理事、副主任委员及常委等。 参考文献 Yang, Y., Wu, Y., Zhao, J. et al. Circulating tumor DNA refines consolidation immunotherapy for limited-stage small cell lung cancer patients. Sig Transduct Target Ther 10, 347 (2025). https://doi.org/10.1038/s41392-025-02445-y