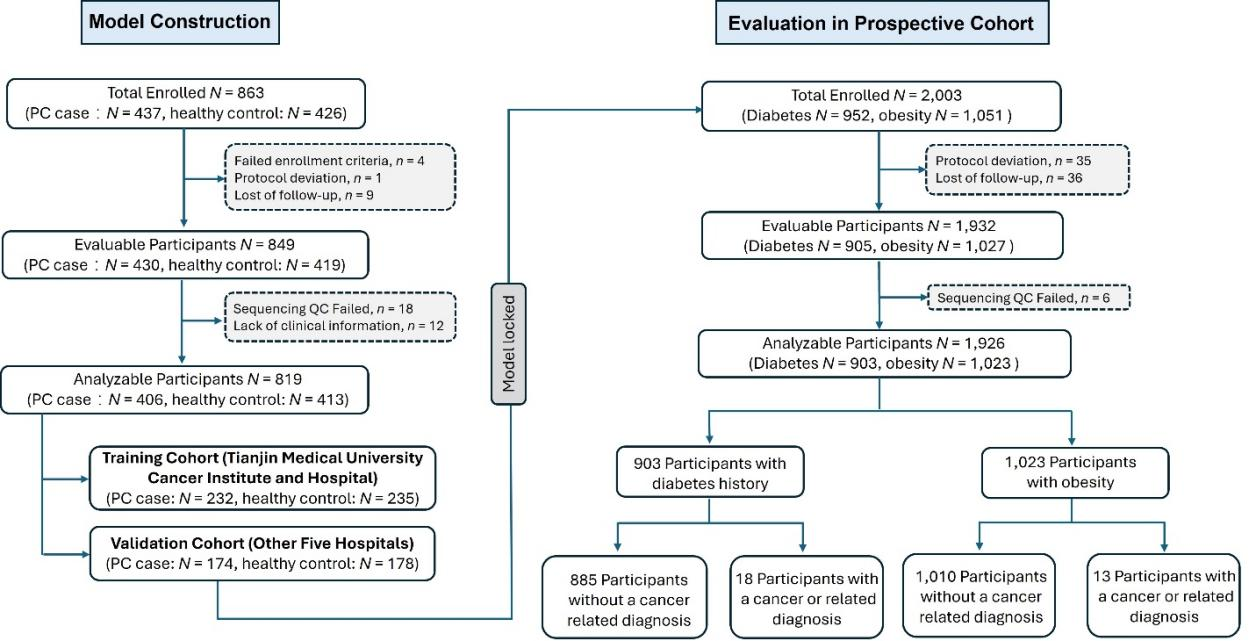
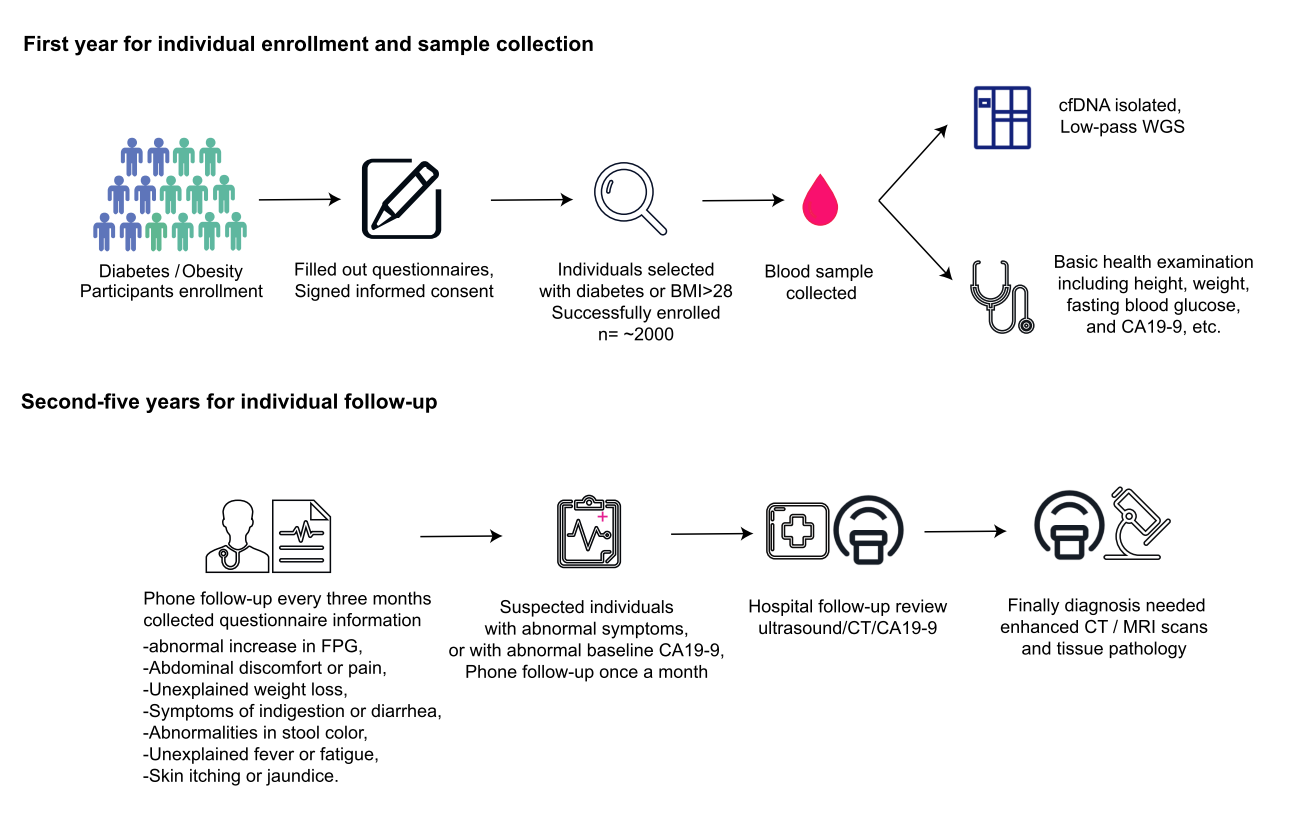
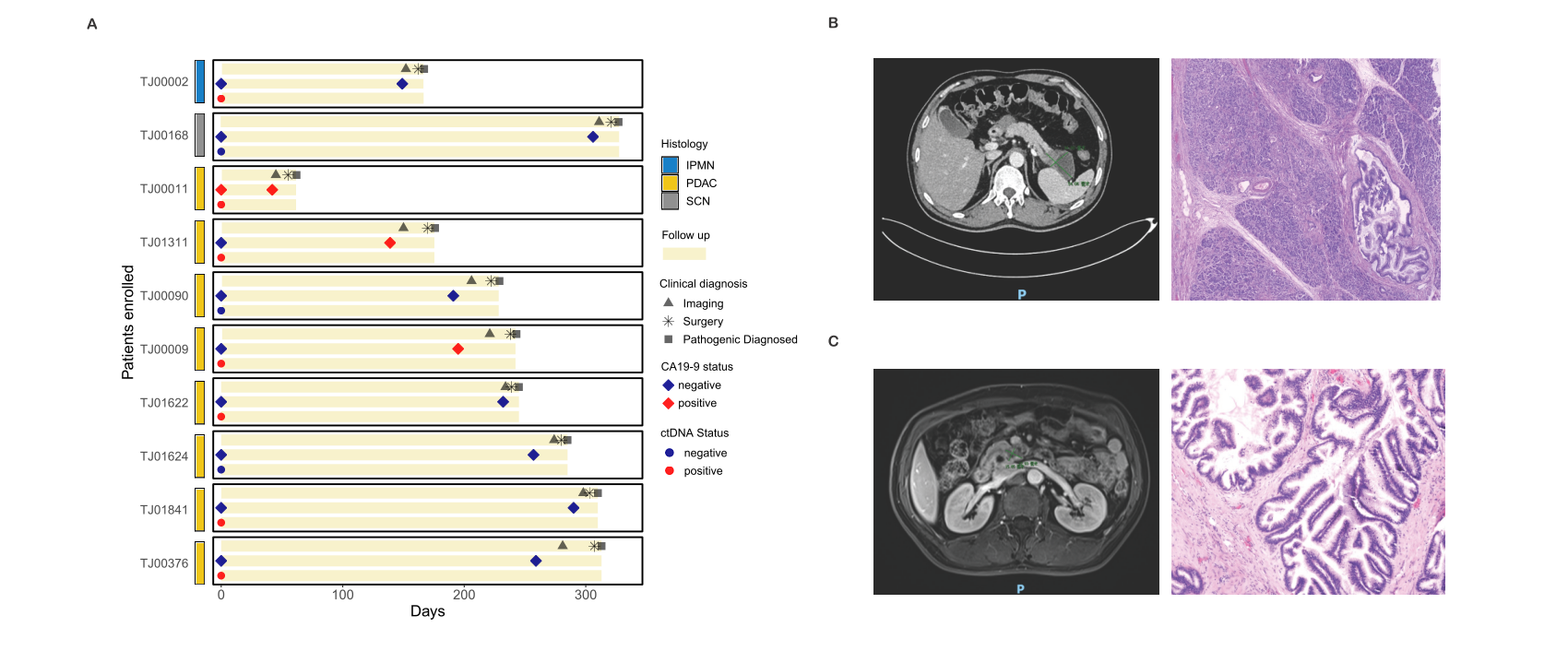
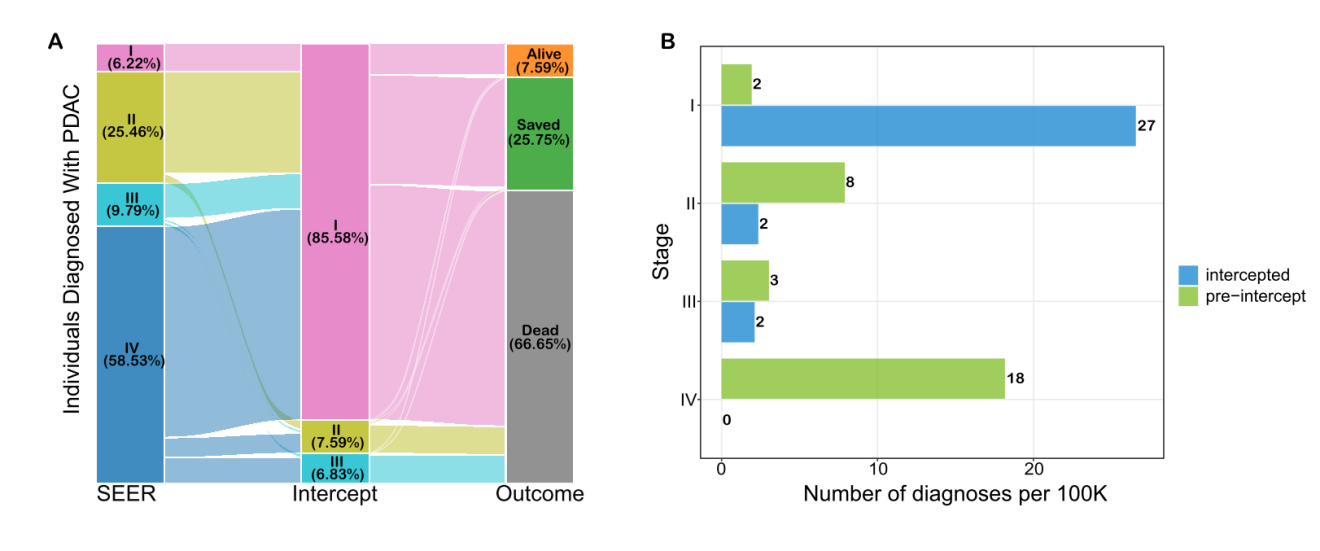
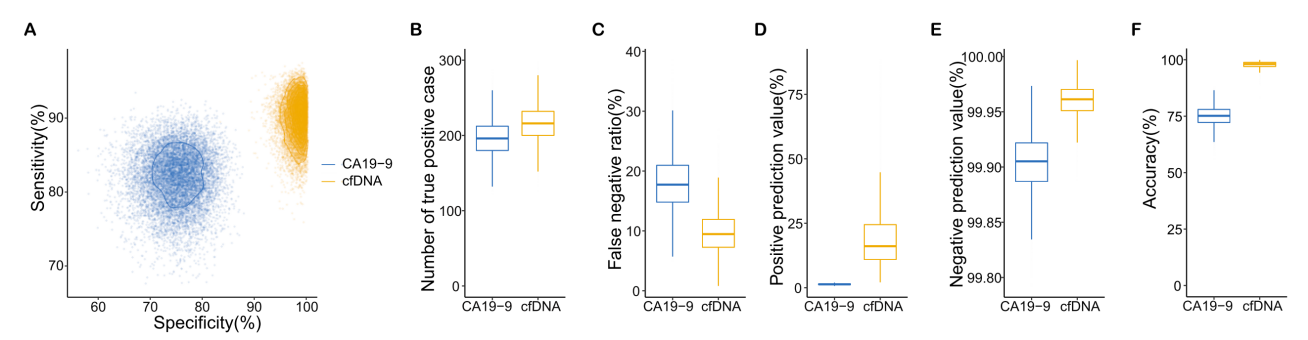
导语 胰腺癌是临床上恶性程度最高的癌症,5年生存率仅为11%[1],被称为“癌中之王”。早期筛查是改善胰腺癌预后的关键,但目前国内外尚无统一早筛方案,开发一种高灵敏度、无创、低成本的早期检测技术成为临床迫切需求。 天津医科大学郝继辉校长团队,联合胰腺肿瘤区域专科联盟多家成员单位,与世和基因合作开展的DECIPHER-P-PDAC研究,基于世和MERCURY cfDNA片段多组学液体活检技术,成功构建了兼具临床有效性与可及性的胰腺癌早筛模型。除训练和验证队列外,研究系统性引入由糖尿病及肥胖人群组成的前瞻性独立队列,不仅用于全面评估模型的性能,更着眼于验证模型在更广泛人群中的普适性,为拓展胰腺癌早筛目标人群、优化筛查路径提供了有力证据。相关研究成果已于近日发表在Cancer Discovery (IF=33.3)[2],天津医科大学肿瘤医院王秀超副主任医师为文章第一作者。 研究亮点 1. 胰腺癌早筛模型性能优异:在训练队列(467例)和验证队列(352例)中的AUC分别达到0.980和0.962,在98%特异性阈值下,分别达到92.2%和90.2%的高灵敏度。 2. 大规模前瞻性肥胖/糖尿病队列验证:团队基于天津市胰腺癌高危人群队列(1926例糖尿病及肥胖人群)证实,模型对早期胰腺癌检出率达75%,较影像学中位提前227.5天发现病变;较传统肿瘤标志物CA19-9性能更优,且能精准分辨胰腺囊肿良恶性,助力临床风险分层。 3. 胰腺癌早筛模型的临床获益显著:模拟研究显示,模型可将胰腺癌Ⅰ期诊断率从6.22%提升至85.58%,因早期诊断带来的绝对生存率改善达25.75%,大幅提升患者生存获益。 研究内容 研究包括三个队列,其中训练队列467例(232例胰腺癌患者和235例健康人)、验证队列352例(174例胰腺癌患者和178例健康人)、肥胖/糖尿病人群前瞻队列1926例(903例糖尿病史、1023例肥胖)。研究通过将机器学习与cfDNA片段多组学特征(拷贝数变异CNV、片段长度分布FSR、片段链偏向性特征OCF)深度整合,开发胰腺癌早期筛查模型,并前瞻性地在真实世界胰腺癌风险人群中验证了该模型的性能。 图1. DECIPHER-P-PDAC研究设计 研究结果 在训练和验证队列中,胰腺癌早筛模型性能卓越 模型在训练队列中AUC达0.980,在独立验证队列中同样保持出色性能,AUC为0.962,显著优于传统肿瘤标志物CA19-9(训练队列AUC=0.819,验证队列AUC=0.876)(图2A)。模型在训练队列中的敏感性为92.2%、特异性为97.9%,在验证队列中的敏感性为90.2%、特异性为97.8%(图2B、C)。 进一步分析显示,更高的模型预测分数与更晚的肿瘤分期及胰头部位肿瘤显著相关(图2D、E)。在154例非癌性胰腺疾病患者(如导管内乳头状黏液肿瘤IPMN、黏液性囊腺瘤 MCN、胰腺炎等)的队列中,与CA19-9相比,模型在区分良恶性病变以及早期检出高危癌前病变方面均性能更优(图2F、G)。 图2. 胰腺癌早筛模型性能评价 在风险人群前瞻队列中,胰腺癌早筛模型性能优于影像学及CA19-9 为在真实应用场景中评估模型的性能,研究纳入由1926名糖尿病史和肥胖参与者组成的胰腺癌风险人群前瞻性队列。所有参与者均接受cfDNA检测,并进行12-24个月的随访(图3)。 图3. 胰腺癌风险人群前瞻性队列的总体研究流程 随访期间共确诊31例癌症及相关疾病,包括8例胰腺癌、1例导管内乳头状黏液肿瘤(IPMN)、1例浆液性囊腺瘤(SCN),以及21例肺、肝、结肠等其他部位的癌症或癌前病变。模型对胰腺癌的检出率达75%(6/8),所有检出病例均为早期(3例0期、1例Ⅰ期、2例Ⅱ期)(图4A),而CA19-9对胰腺癌的检出率仅12.5%(1/8,且为II期)。 与影像学相比,模型能提前45-298天(中位227.5天)发现病变,为胰腺癌早期诊断争取关键时间窗口。同时,模型还能精准区分胰腺囊肿风险,将高危IPMN判定为阳性、低危SCN判定为阴性(图4A),凸显其在胰腺囊肿风险分层中的潜在价值。此外,临床常用的泛癌肿瘤标志物CA19-9在胰腺癌筛查中存在局限。研究发现,即使在患者出现胰腺癌相关症状后进行CA19-9检测,其性能仍不理想:有2例病例在影像学确认胰腺异常前一个月内CA19-9检测结果仍为阴性(图4B、C)。因此,模型不仅能高效识别胰腺癌病例,还能实现更早发现,甚至有望在高危病变进展为恶性肿瘤前就发现异常。 图4. 模型在前瞻性队列中的性能及筛查发现的胰腺癌相关病例 胰腺癌早筛模型可提升临床早期诊断率与生存获益 无筛查实施时,仅6.22%胰腺癌患者在Ⅰ期确诊,58.53%在Ⅳ期确诊,5年生存率仅7.59%;该模型若应用于临床,预计85.58%患者能在Ⅰ期确诊,理想条件下无Ⅳ期病例,5年生存率可提升至33.34%,因早期诊断带来的绝对生存率改善达25.75%(图5)。 图5. 应用胰腺癌早筛模型进行临床干预的模拟结果 为评估模型的筛查潜力,研究对10万人假设人群开展蒙特卡洛模拟,结果显示相较于CA19-9,模型额外检出20例胰腺癌,敏感性提升8.22%,且阳性预测值(19.60%)与准确率(97.77%)均显著更优(图6)。模拟分析表明,模型可大幅提升患者生存率,为破解胰腺癌 “早诊难、预后差” 的临床困境提供了新策略。 图6. CA19-9与胰腺癌早筛模型在10万人假设人群中的性能对比 结语 研究基于世和MERCURY cfDNA片段组学液体活检技术,通过多层证据级别的队列设计,成功开发出性能优异的胰腺癌早筛模型。该模型不仅在病例-对照研究中展现出高敏感性与特异性,在更广泛的肥胖/糖尿病人群前瞻性队列中也证实了其真实临床价值:模型能够更早地检出早期胰腺癌,并对胰腺囊肿进行精准风险分层,其性能显著优于传统标志物CA19-9,有助于降低假阳性结果带来的医疗负担和患者焦虑。未来,该模型有望成为胰腺癌早筛的重要手段,推动胰腺癌从晚期确诊向早期干预转变,最终改善患者生存结局,为胰腺癌诊疗领域带来里程碑式突破。 专家简介 郝继辉 教授 天津医科大学校长 天津医科大学肿瘤医院院长 教授、主任医师、博士生导师 国家杰出青年科学基金获得者 “长江学者”特聘教授 国家“万人计划”科技创新领军人才 科技部重点领域创新团队带头人 百千万人才工程国家级人选 国家卫生健康突出贡献中青年专家 国家恶性肿瘤临床医学研究中心执行副主任、药物成药性评价与系统转化全国重点实验室副主任、天津市消化系统肿瘤重点实验室主任 国家肿瘤质控中心胰腺癌质控专家委员会主任委员 中国抗癌协会副理事长、天津市抗癌协会理事长 中国抗癌协会肿瘤精准治疗专业委员会候任主委 中国抗癌协会胰腺癌专业委员会副主任委员 Cancer Biology & Medicine、《中国临床肿瘤》执行主编 以第一完成人获得教育部高等学校科学研究优秀成果奖(科学技术)一等奖、天津市自然科学特等奖、天津市科技进步一等奖、华夏医学科技奖科学技术一等奖、中国抗癌协会科技奖一等奖和中华医学科技奖医学科学技术奖、教育部霍英东教学成果奖等科技奖励10余项 主持国家重点研发计划、国自然重点项目等省部级以上课题10余项 以第一作者或通讯作者(含共同)在Cancer Cell、Cell Res.、Cancer Discov.、Gut、Gastroenterolog、Sci Adv.、Nat. Commun.、J. Exp. Med.等权威期刊发表论文百余篇 王秀超 教授 天津医科大学肿瘤医院 肿瘤学博士、副主任医师、博士生导师 美国宾夕法尼亚州立大学博士后 天津市“131” 创新人才,青年医学新锐 2025年度新时代青年先锋奖 中国研究型医院协会微创外科分会委员 天津市抗癌协会胰腺癌专业委员会委员 天津市青年联合会常务委员,天津市优秀科技工作者 主持国家级课题4项,发表SCI论文30余篇,获天津市自然科学特等奖,天津市科技进步一等奖、教育部科技一等奖以及中国抗癌协会科技一等奖等 参考文献 [1] Kenner B, Chari ST, Kelsen D, Klimstra DS, Pandol SJ, Rosenthal M, et al. Artificial Intelligence and Early Detection of Pancreatic Cancer: 2020 Summative Review. Pancreas. 2021; 50(3): 251-279. [2] Wang X, Wang H, Zhang M, Li H, Liu Y, Huang H, et al. Development and Prospective Validation of a Cell-free DNA-based Model for the Early Detection of Pancreatic Cancer. Cancer Discov. 2025.